世界のアンメット・メディカル・ニーズに応えるべく、挑戦を通じてブレイクスルー医薬品をいちはやく患者さんに届ける努力をしてまいります。
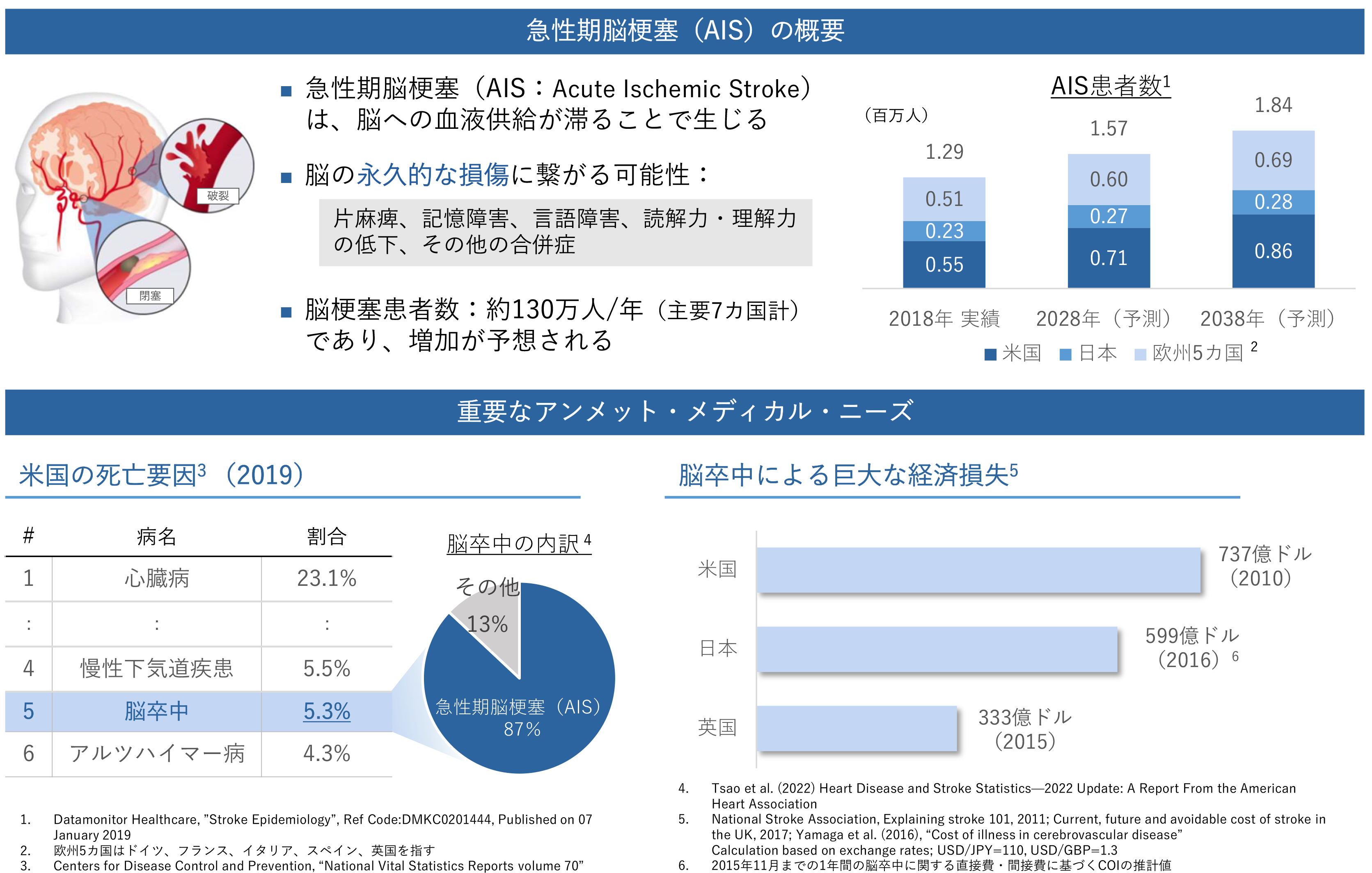
現在、FDA(アメリカ食品医薬品局)に承認されている唯一の急性期脳梗塞の治療薬であるt-PA(組織型プラスミノーゲン・アクティベータ;血栓溶解薬)には、発症後原則として4.5時間までの使用制限、症候性頭蓋内出血リスクといった課題が存在します。そのため、t-PAは急性期脳梗塞の全患者のうち10%未満にしか使用されておらず(出典:Intern Med 54:171-177, Prehospital Delay and Stroke-related Symptoms)、急性期脳梗塞には高いアンメット・メディカル・ニーズが存在します。
また、1996年のt-PAのFDA承認以降の約25年間、急性期脳梗塞に対する新たなFDA承認薬はなく(2022年8月31日時点)、新たな承認薬が望まれています。
開発中のパイプラインおよびTMS-008についてはこちらをご覧ください。