株式会社ティムス代表取締役社長の若林です。
急性期脳梗塞治療における新薬開発は、t-PA(アルテプラーゼ)の登場から長らく停滞してきました。そのなかで私たちが挑んできたのが、TMS-007という新しい選択肢です。
本稿では、私たちが実施した前期第2相試験の結果をもとに、この新薬候補がなぜ注目を集めているのか、そしてどのような可能性が見えてきたのかをお伝えできればと思います。
※本ページは、当社の研究開発状況をお伝えするものであり、医薬品の効能・効果を保証するものではありません。記載内容は治験段階の情報を含みます。
急性期脳梗塞の治療薬として1996年にt-PA(アルテプラーゼ)が登場してから、今日に至るまで、同じ疾患領域で米国FDAによって新しい薬が承認されたことはありません(※)。
- ※ 2025年に米国FDAにより承認されたテネクテプラーゼ(商品名:TNKase)は、心筋梗塞用途で承認済の改良型t-PAであり、承認前から脳梗塞用途にも用いられています。
ですが、t-PAの投与時間制限(発症後原則4.5時間以内)や出血リスクを背景に、「使用できる患者」がごく限られるという課題は長年指摘されてきました。製薬業界でも新たな治療薬の開発が進められてきましたが、多くが治験の壁を越えることができず、失敗に終わっています。
そうした背景のなかで、ティムスが開発を進めているTMS-007は、日本国内で実施された前期第2相臨床試験で、過去の脳梗塞薬候補では見られなかったような結果を示しました。
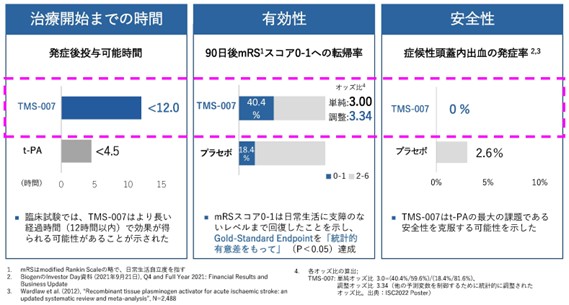
TMS-007の前期第2相臨床試験では、発症後12時間以内という条件下で、主に中等度の脳梗塞患者を対象に投与が行われました。この「12時間」という条件は、t-PAの約2.5倍、より多くの患者が対象となる可能性があります。一方で、脳梗塞の治療は発症から時間が経つほど難しくなるため、治験としても難しいものでした。
この厳しい条件下で、90日後のExcellent Outcome(非常に良好な結果)が、TMS-007投与群では約40%、プラセボ群では約18%と、2倍以上の差がつきました。この「非常に良好な結果」とは、自立度を表すmRSという7段階のスコアにおいて、ほぼ健康体であることを示す0または1のスコアを達成した患者の比率を指します。
さらに前回の投稿でも記載の通り、前期第2相臨床試験では、TMS‑007群で症候性脳出血(sICH)は0%(0/52)となり、出血リスクの低さが示唆されました。出血リスクは、t-PAや他の脳梗塞薬候補において課題とされてきた指標です。プラセボ群の2.6%(1/38)よりも良い結果となったことは注目に値します。
- 拡大
- (TMS-007前期第2相臨床試験の主な結果)
- ※ 上記のデータは、TMS-007とt-PAを直接比較した臨床試験に基づくものではありませんのでご注意ください。
実際、当社が日本で行った前期第2相試験の結果というのは、これまでに私が目にしてきた数多くの脳梗塞の臨床試験の中でも、非常に良い結果だったと感じています。網羅的に全試験を比較したわけではないため断言は避けますが、私は脳梗塞の臨床試験でこれほどプラセボとの差がついたデータは見たことがありません。
治験はあくまで開発段階であり今後も検証が必要ですが、それでもこの結果は、「TMS-007が急性期脳梗塞治療薬開発の一つの壁を越えた」という評価に値すると考えています。
TMS-007の血栓溶解効果や抗炎症による保護効果など、作用機序については、こちらの記事でご紹介しています。
TMS-007は現在、グローバル臨床試験のORION試験(4.5~24時間以内の急性期脳梗塞を対象)が進行中です。詳しくは、2025年5月28日付「TMS-007(JX10)の開発に関するお知らせ」、8月28日付「TMS-007(JX10)の開発に関するお知らせ」、並びに、6月30日に公開しました、TMS-007(JX10)の臨床試験に関する東北大学大学院 新妻邦泰教授との対談動画「JX10(TMS-007)臨床開発の展望」をご覧ください。
ティムスでは、パートナー企業と共に第2相/第3相試験である「ORION」を着実に遂行し、現在の治療では救えていない脳梗塞患者にTMS-007を新薬として届けることを見据えています。