急性期脳梗塞の治療薬として、SMTP化合物群に属するTMS-007を開発中です。世界では、脳梗塞により年間約330万人が命を落としています(*1)。また、脳梗塞を含む脳血管疾患は、介護が必要となった原因として最も多い重大な疾患です(*2)。急性期脳梗塞の治療薬のほぼ唯一の選択肢として、血栓溶解薬である組織型プラスミノーゲンアクチベーター( t-PA:アルテプラーゼ)があります。tPAの使用は発症後4.5時間以内に限られているため、先進国においても脳梗塞患者の5~10%にしか投与されていないと言われています。TMS-007は投与可能時間枠を大幅に延ばすことにより、多くの患者が治療できるようになると期待されています。
前期第Ⅱ相臨床試験(*3)は、発症から12時間までの急性期脳梗塞患者に対する安全性と有効性を評価することを目的に、無作為化・プラセボ対照・二重盲検試験としてデザインされました。その結果、以下のように安全性と有効性の主要評価項目の目標を達成しました(試験結果のリリースはこちら)。TMS-007 はリスクとベネフィットのバランスが良好であることから、次世代の血栓溶解薬になる可能性があります。
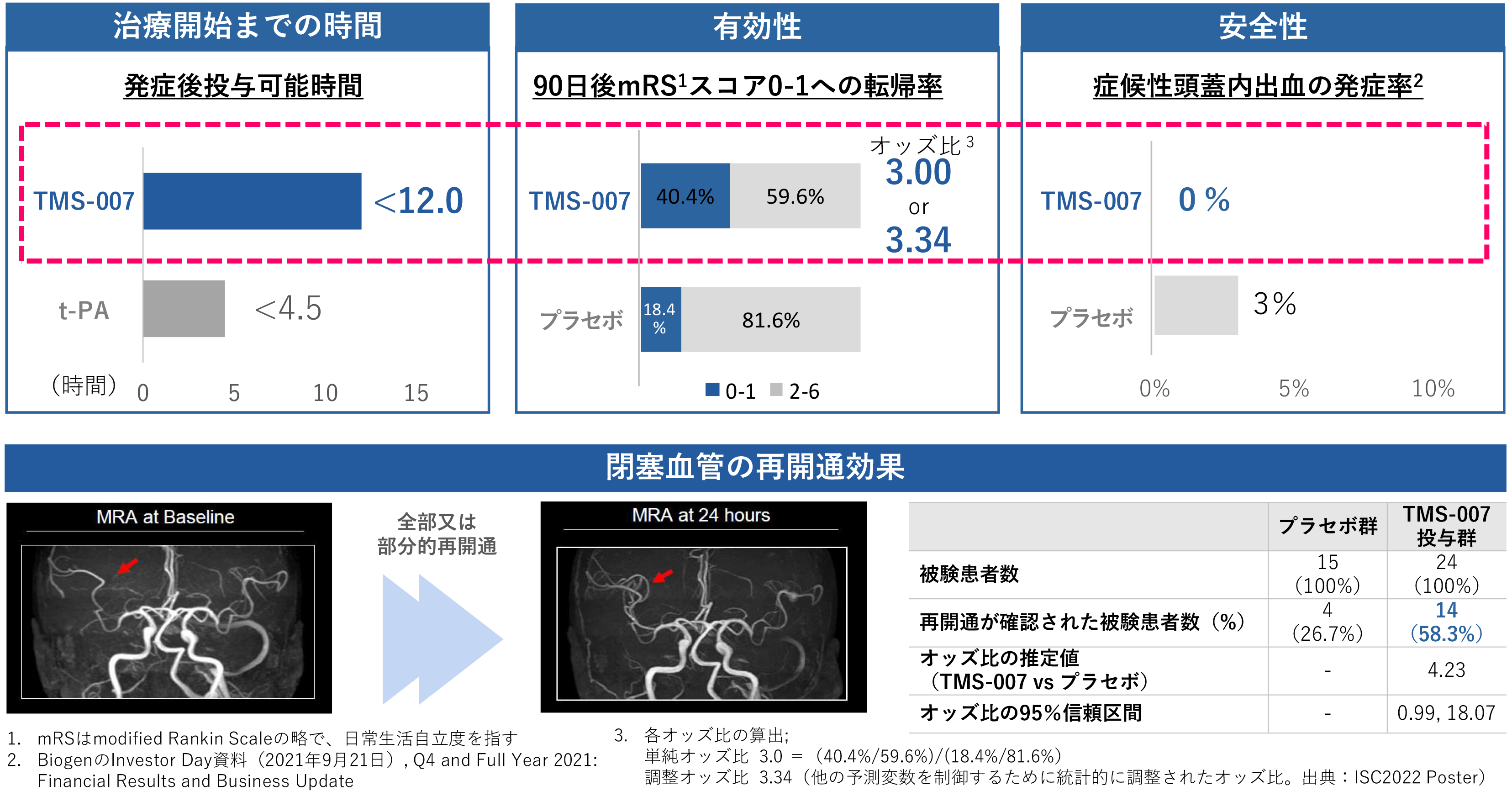
本臨床試験は、多施設・単回投与・二重盲検・無作為化・プラセボ対照・用量漸増試験として、当社が国内で実施しました。対象としたのは、急性期脳梗塞の発症後 12 時間以内で組織プラスミノゲン活性化因子(t-PA)による治療または血栓除去術を受けることが適切でない患者さんです。TMS-007 投与群の 3 つのグループ(体重 1 kg あたり 1 mg、3 mg、 6 mg)に 52 名、プラセボ投与群に 38 名のご登録をいただきました。
TMS-007は、SMTP化合物の一つであり、(1)血栓溶解作用、(2)抗炎症作用、(3)抗酸化作用の全てを併せ持っていると考えられています(TMS-007の薬理作用についてはこちら)。
脳梗塞は死亡者数が多く、また介護を必要とする障害をもたらす主要な原因である重大な疾患であるにもかかわらず、その治療の選択肢は限定されています。当社はTMS-007を新たな治療薬として一刻も早くお届けすることができるよう、努力しています。